Акции Sarepta Therapeutics резко упали после закрытия торгов в Нью-Йорке после публикации в Bloomberg сообщения об электронном письме Детской больницы Лос-Анджелеса (CHLA), в котором компания объявила о прекращении использования препарата Elevidys, препарата для генной терапии мышечной дистрофии Дюшенна. Решение было принято после двух сообщений о смерти, связанных с этим лечением.
CHLA прекратила использование препарата «Элевидис» в прошлую пятницу — в тот же день, когда Управление по санитарному надзору за качеством пищевых продуктов и медикаментов потребовало от компании Sarepta прекратить распространение препарата. Sarepta с тех пор отказалась.
«Безопасность пациентов имеет первостепенное значение в CHLA, и больница сообщила о своем решении семьям пострадавших пациентов, ожидая дальнейшего решения FDA», — сообщил представитель CHLA агентству Bloomberg News в электронном письме.
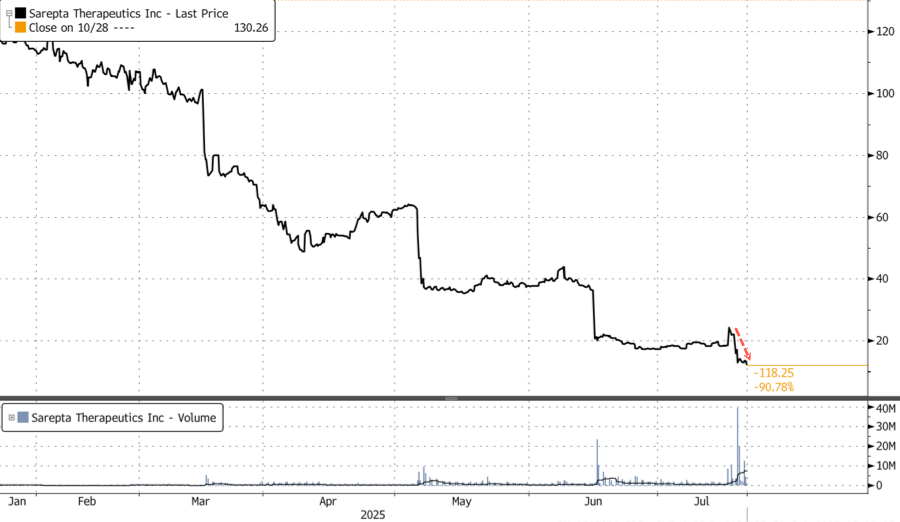
На постмаркетинговых торгах акции упали ещё на 9%, усугубив дневное падение на 5,36%. С начала года акции упали на колоссальные 89%, достигнув минимумов, не наблюдавшихся с 2015 года.
Ранее аналитик HC Wainwright & Co. Митчелл С. Капур совершил редкий для себя поступок, снизив целевую цену акций Sarepta до нуля с прежнего уровня в $10, сохранив при этом рекомендацию продавать. Согласно последним данным Bloomberg, по акциям 3 рейтинга «продавать», 16 — «держать» и 7 — «покупать». Средний 12-месячный целевой показатель аналитиков Уолл-стрит составляет $30,41.
«Мы считаем, что эта битва с регулирующим органом США, контролирующим ситуацию, проигрышна», — сказал Капур клиентам, добавив: «Поскольку просьба о добровольном действии, скорее всего, была вежливой, мы ожидаем, что FDA в конечном итоге потребует изъять Elevidys с рынка».
Он отметил: «В отсутствие будущих доходов Elevidys мы не видим никакой внутренней стоимости акций SRPT».
Аналитик Deutsche Bank Дэвид Хоанг сообщил клиентам: «Мы ожидаем, что эта череда событий и отсутствие прозрачности серьезно подорвут спрос пациентов, и, возможно, на восстановление доверия потребуются годы».
* * *
Компания Sarepta Therapeutics Inc. отклонила запрос Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США о приостановке всех поставок препарата для генной терапии Elevidys после смерти трех пациентов, сообщило агентство Bloomberg в эти выходные.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) сообщило, что двое подростков с мышечной дистрофией Дюшенна, оба неспособные ходить, недавно умерли от острой печеночной недостаточности после приема препарата Элевидис . Кроме того, в прошлом месяце умер 51-летний участник испытания другой генной терапии Sarepta, направленной на лечение конечностно-поясной мышечной дистрофии, также от острой печеночной недостаточности.
Bloomberg сообщает , что после этих событий представители FDA встретились с Sarepta и попросили компанию добровольно приостановить поставки препарата Elevidys , на который приходится более половины выручки компании. «Компания отказалась это сделать», — заявило агентство.
В своем заявлении в пятницу компания Sarepta защитила свое решение продолжить распространение препарата «на основе нашей всесторонней научной интерпретации данных, которая не выявила никаких новых или изменившихся сигналов безопасности» у пациентов, которые по-прежнему могут передвигаться амбулаторно.
В июне компания уже приостановила поставки препарата Элевидис пациентам, не способным самостоятельно передвигаться. По данным Sarepta, около 85% пациентов, прошедших лечение препаратом с момента его запуска, — мальчики, которые всё ещё могут ходить.
Комиссар FDA Марти Макари заявил в пятницу в интервью, что агентство рассматривает вопрос о том, следует ли оставлять Elevidys на рынке.
Последняя смерть связана с генной терапией, использующей ту же вирусную платформу доставки, что и Elevidys , что предполагает потенциальные более широкие последствия для безопасности. «Мы считаем, что риски полного изъятия препарата FDA с рынка теперь значительно возросли», — написал аналитик Baird Брайан Скорни в своей пятничной заметке.
В пятницу, около 13:00 по восточному времени, агентство Reuters со ссылкой на источник, знакомый с ситуацией, сообщило, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) обратится к компании Sarepta с просьбой прекратить все поставки препарата «Элевидис». К 13:30 по восточному времени об этом сообщило агентство Bloomberg.
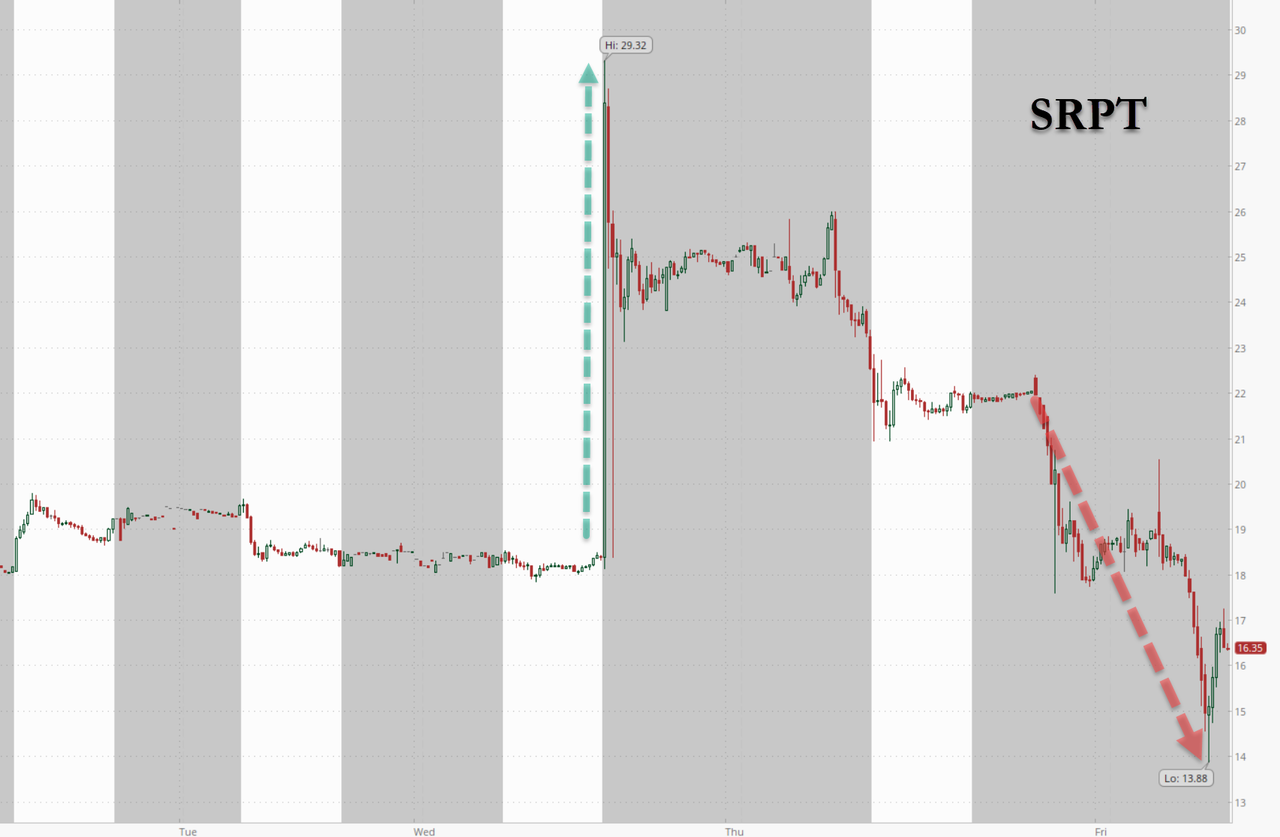
Компания подтвердила третью смерть пациента, связанную с ее программами генной терапии. На этот раз речь идет о 51-летнем мужчине, который умер в июне от острой печеночной недостаточности после получения экспериментальной терапии SRP-9004 для лечения конечностно-поясной мышечной дистрофии (КПМД).
Компания подтвердила BioSpace информацию о смерти , и в пятницу утром об этом широко сообщалось. Акции Sarepta упали примерно на 25% к открытию торгов и в итоге закрылись с падением более чем на 30%.
Как и Elevidys — одобренный компанией Sarepta препарат для генной терапии мышечной дистрофии Дюшенна, — SRP-9004 использует вектор аденоассоциированного вируса (AAV), который компания ранее связывала со смертельными осложнениями печени.
Смерть, о которой не было упомянуто в ходе обновления корпоративной реструктуризации Sarepta в начале прошлой недели, привлекла пристальное внимание аналитиков.
«Мы считаем, что смерть пациента с ПЛМД может усилить нежелание пациентов использовать коммерческий Элевидис и усилить недоверие инвесторов, поскольку компания не раскрыла это событие в своем заявлении», — отметил в пятницу Уильям Блэр.


Комментариев нет:
Отправить комментарий